中国研究型医院学会血栓与止血专委会通信作者:周洲,Email:fwcomd@126.com;宋鉴清,Email:songlisw@yeah.net【摘要】活化部分凝血活酶时间(APTT)延长混合血浆纠正试验用于鉴别凝血筛选试验中APTT延长的原因——凝血因子缺乏或存在凝血抑制物。该试验有助于医生结合患者临床表现初步判断患者APTT延长异常的原因,以及针对性选择下一步实验室检查项目,所以是有重要价值的凝血试验。目前,因该试验的操作流程及结果解读暂无统一标准,实验室应用较为混乱,结果缺乏可比性,也限制了其应用和普及。本共识参考国内外相关文献,结合出凝血检验领域专家的实践经验,致力于推进APTT延长混合血浆纠正试验的标准化。【关键词】活化部分凝血活酶时间;混合血浆纠正试验;凝血因子;血友病ChineseexpertconsensusonoperationprocedureandresultinterpretationofAPTTmixingtestChineseSocietyonThrombosisandHemostasisCorrespondingauthor:ZhouZhou,Email:fwcomd@126.com;SongJianqing,Email:songlisw@yeah.net【Abstract】Activatedpartialthromboplastintime(APTT)mixingtestisusedtoinvestigatewhetherthecauseofprolongedAPTTiscoagulationfactordeficiencyorexistingcoagulationinhibitor.CombinationofthistestandclinicalmanifestationofpatientcanhelpclinicianstopreliminarilyjudgethereasonofprolongedAPTT,andselecttargetedfurthertests,henceit′savaluablecoagulationscreeningtest.SincetherearenostandardsaboutoperationprocedureandresultinterpretationofAPTTmixingtestyet,itsclinicalapplicationisabitconfusingandpopularityhasalsobeenhinderedduetothepoorcomparability.Thisconsensuscontainedreferencestothereleventdomesticandforeignliteratures,andpracticalexperiencesofthelaboratoryexpertsinthrombosisandhaemostasisfield,thusaimstopromotethestandardizationofAPTTmixingtest.【Keywords】Activatedpartialthromboplastintime;Mixingtest;Coagulationfactor;Hemophilia
活化部分凝血活酶时间(activatedpartialthromboplastintime,APTT)是医疗机构采用的出凝血功能筛选试验,APTT延长常见的原因包括凝血因子缺乏、存在狼疮抗凝物(lupusanticoagulant,LA)或凝血因子抑制物等。明确诊断需检测凝血因子水平,稀释蝰蛇毒凝血时间试验和硅凝固时间检测LA,改良的Nijmegen方法检测凝血因子抑制物。APTT延长混合血浆纠正试验(以下简称APTT纠正试验)是将患者血浆(patientplasma,PP)与正常混合血浆(NormalPooledPlasma,NPP)按照一定比例混合后多次检测APTT,评估混合血浆APTT“纠正”的程度,为确诊试验的选择提供指导。目前APTT纠正试验的检测时机、操作流程和结果解读方法众多,暂无统一标准,报告模式较为混乱,限制·指南与共识·DOI:10.3760/cma.j.cn114452-20201202-00870
收稿日期2020-12-02本文编辑唐栋引用本文:中国研究型医院学会血栓与止血专委会.活化部分凝血活酶时间延长混合血浆纠正试验操作流程及结果解读中国专家共识[J].中华检验医学杂志,2021,44(8):690-697.DOI:10.3760/cma.j.cn114452-20201202-00870.·690·fmx_T3RoZXJNaXJyb3Jz中华检验医学杂志2021年8月第44卷第8期ChinJLabMed,August2021,Vol.44,No.8了其应用的普及性。
中国研究型医院学会血栓与止血专委会组织出凝血领域专家总结相关实践经验并参考国内外文献就该试验的启动时机、操作流程、结果解读、注意事项及报告模式共同编写本共识,以推进APTT纠正试验的标准化,供出凝血领域的医生、检验医师/技师等相关从业人员在处理APTT单独延长的患者时参考。
一、混合血浆纠正试验混合血浆纠正试验是当PP凝固时间不明原因延长时,将PP与NPP按照一定比例混合后,重新检测凝固时间的筛选试验。一般来说,当所有凝血因子活性水平在50%及以上时,即可确保APTT维持在参考范围内(不同APTT试剂对于凝血因子缺乏敏感性有差异,参考范围不同,建议先进行相关验证)。因此当缺乏一种或多种内源性凝血因子的PP与NPP(理论上所有凝血因子活性在100%左右)按1∶1的比例混合后,理论上混合血浆中凝血因子活性均应≥50%,APTT检测结果可纠正至参考范围内。而当PP存在凝血抑制物,如抗凝药物、凝血因子抑制物、抗磷脂抗体等时,混合后APTT不能纠正至参考范围内[1‑5]。混合血浆纠正试验的目的即是初步判断延长的血浆凝固时间是由于缺乏凝血因子还是存在凝血抑制物所致,指导进一步确诊凝血试验的选择[3,5‑7]。混合血浆纠正试验主要应用于APTT,当然也可应用于凝血酶原时间(prothrombintime,PT)及凝血酶时间(thrombintime,TT)。
二、启动APTT纠正试验的时机APTT不明原因明显超出正常对照时即可考虑启动APTT纠正试验,建议同时结合患者临床表现及临床的需求来确定。在已知患者接受抗凝治疗的情况下,APTT纠正试验结果是可预测的,然而,当患者疑似正在服用抗凝药,但具体的治疗方案尚不清楚时,APTT纠正试验可能会成为鉴别诊断策略的一部分[8],以识别应优先启动哪些后续试验。建议1APTT结果不明原因超出正常对照至少5s,患者有相关症状、体征或临床医生需要进一步了解APTT延长的原因时,可启动APTT纠正试验。
三、APTT纠正试验方法(一)NPP的制备与保存1.建议优先使用商品化正常血浆用于APTT纠正试验,商品化正常血浆的使用和保存应按照制造商说明书进行操作。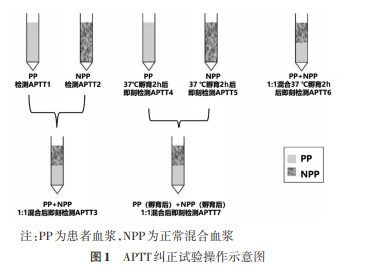
2.若无法获得商品化正常血浆,可选择至少20份(男女比例1︰1)常规凝血试验均正常的血浆混合制备(理想凝血因子水平应在80%~120%之间)。应避免选择感染、肿瘤、创伤、术后、妊娠、新生儿、肝炎、自身免疫性疾病等人群标本。个体标本性状要求无溶血、凝块、黄疸和脂血等,从每名供者标本中采集足够的血浆以达到最终所需的NPP量[9]。理想的NPP包括:(1)至少20份常规凝血试验均正常的血浆混合制备,以便使得每种凝血因子水平接近100%;(2)所有单个血浆标本的血小板计数应<10×109/L;(3)NPP中不含LA[8]。3.将源自每名供者的等体积血浆(建议等体积)合并到同一容器中,混合后再次离心(离心力1500×g,时间15min)。最好每次做APTT纠正试验前新鲜制备,也可分装至冻存管中冻存(至少-20℃),使用时将冻存管取出后在37℃水浴中约5~10min或至完全融化,并轻轻颠倒混匀后进行试验,禁止反复冻融使用。应避免在37℃孵育时间不足或过长,否则可能会因形成冷沉淀或热失活而导致凝血因子活性的损失。复溶后应重新检测APTT,APTT需在正常参考范围内才可进行纠正试验。4.自制NPP如需冻存时,应放置于非自动除霜冰箱[9],-20℃条件下仅能放置2周,-70℃条件下可放置6个月,而-80℃深低温冰箱保存则可维持NPP的凝血性质等同于新鲜血浆,保证凝血因子、抗凝物质的活性,可至少稳定8个月[10‑12]。保存温度越低,凝血因子的促凝活性保持时间也越长。(二)APTT纠正试验的操作方法完整的APTT纠正试验包括对混合血浆的即刻测定和孵育后测定两个步骤(图1)。混合比例通常采用PP和NPP进行1︰1混合,对于低滴度的抑制物可考虑使用4︰1混合的APTT纠正试验。1.即刻APTT纠正试验:(1)检测PP得到APTT1;(2)检测NPP得到APTT2;(3)将PP和NPP1︰1混合后即刻检测得出APTT3。2.孵育APTT纠正试验:(1)将PP、NPP、PP和NPP1∶1混合血浆的容器封口,置于37℃水浴箱孵育2h。水浴时间的控制非常重要,水浴超过2h,有提高假阳性的风险[13]。(2)待准确孵育2h后,分别即刻检测孵育后的PP、NPP和1︰1混合血浆得到APTT4、APTT5、APTT6,同时将孵育后的PP和NPP以1︰1混合后即刻检测得到APTT7。建议2可根据病情需要、实验室具体情况选·691·fmx_T3RoZXJNaXJyb3Jz中华检验医学杂志2021年8月第44卷第8期ChinJLabMed,August2021,Vol.44,No.8择相应的试验;所有混合后血浆检测APTT均应即刻进行,排除因放置时间过久导致的试验误差。
四、APTT纠正试验结果判断及分析(一)APTT纠正试验结果判断完整的APTT纠正试验结果解释:(1)APTT3、APTT6均纠正提示凝血因子缺乏,不存在抑制物;(2)APTT3纠正、APTT6延长超过相应的临界值,提示存在抑制物且为时间和温度依赖性;(3)APTT3、APTT6均不纠正、APTT6比APTT7延长不超过相应的临界值,提示存在抑制物,但抑制作用不存在时间和温度依赖性;若APTT6比APTT7延长超过相应的临界值,则抑制作用有时间和温度依赖性;(4)APTT4、APTT5、APTT7分别作为APTT1、APTT2、APTT3的平行对照,以便于对实验条件进行监控。当后者相比前者明显延长时,则提示实验过程中有不稳定因素,如孵育温度超过可接受范围或者存在pH值的明显变化,那么有理由认为该次试验的结果不可信,需要重新进行孵育试验。(二)常用的APTT纠正试验结果判断方法1.即刻APTT纠正试验:文献报道用于将APTT纠正试验解释为“纠正”(凝血因子缺乏)或“未纠正”(凝血抑制物)[2‑3,8,14]的常用方法有4种。(1)正常参考范围/正常参考区间方法:将检测结果与正常参考范围(normalreferencerange,NRR)或正常参考区间(normalreferenceinterval,NRI)进行比较。临床与实验室标准化协会(ClinicalandLaboratoryStandardsInstitute,CLSI)指南[15]等建议结果在NRR/NRI范围即为“纠正”[2,15]。该方法主要优点是易于应用和验证,并且不需要制定其他替代的验证方法和临界值;主要缺陷是如果“异常”患者APTT试验结果刚好位于NRR/NRI上限,可能的结果是无论患者血浆中是否存在抑制物,APTT纠正试验结果都在NNR/NRI范围内,此时APTT纠正试验表现出来的“纠正”可能仅仅是由于抑制物的稀释造成[1‑2,16]。(2)循环抗凝物指数(indexofcirculationanticoagulant,ICA)方法:ICA方法也称为“罗斯纳指数”(Rosnerindex,RI)方法,以该方法的倡导者命名,最初是为LA研究而开发的。RI的计算公式为:RI=[(APTT3‑APTT2)/APTT1]×100%,通常临界值范围为10%~15%[8]。建议3即刻纠正结果的RI临界值范围为10%~15%,低于10%提示因子缺乏,高于15%提示存在凝血抑制物,10%~15%为临界值(灰区)。(3)百分比纠正法:也称为“Chang”法[17],以该方法的倡导者命名。百分比纠正法的公式为:%纠正=[(APTT1‑APTT3)(/APTT1‑APTT2)]×100%,关于临界值的文献报道略有差异[8,17‑18]。(4)其他方法:①超过正常混合血浆5s以内(或延长<15%)为“纠正”;超过正常混合血浆5s以上(或延长>15%)为不纠正[19]。②文献[11,20‑21]建议将健康人群凝血时间的第99个百分位数设置为纠正与否的临界值,并且应该由本地试剂和凝血仪组合确定。建议4以上所有方法存均不能100%区分凝血因子缺乏与凝血抑制物,如需明确诊断尚需结合相应的确认试验进行综合的判断,且宜建立本地实验室的临界值并定期验证。2.孵育APTT纠正试验(1)APTT6是否纠正的判断方法如下,请根据自身需求选择与即刻纠正试验对应的同类型判断方法。①正常参考范围/正常参考区间方法:将检测结果与NRR或NRI进行比较。CLSI指南[15]等建议结果在NRR/NRI范围即为“纠正”[2]。②ICA方法:孵育2h后RI(RI2h)的计算公式为:RI2h=[(APTT6‑APTT5)/APTT4]×100%。③百分比纠正法:百分比纠正法的公式为:%纠正=[(APTT4‑APTT6)(/APTT4‑APTT5)]×100%。④超过正常混合血浆5s以内(或延长<15%)为“纠正”;超过正常混合血浆5s以上(或延长>15%)为不纠正[19]。⑤文献建议[11,20‑21]将健康人群凝血时间的第99个百分位数设置为纠正与否的临界值,并且应该由本地试剂和凝血仪组合确定。(2)“时间依赖差”的判断方法如下:①将“时间依赖差”定义为“Δ=APTT6‑APTT7”,通常该差值Δ>3s则提示存在时间和温度依赖性抑制物(如FⅧ抑注:PP为患者血浆,NPP为正常混合血浆图1APTT纠正试验操作示意图·692·fmx_T3RoZXJNaXJyb3Jz中华检验医学杂志2021年8月第44卷第8期ChinJLabMed,August2021,Vol.44,No.8制物)[22‑23]。②若APTT6比APTT7延长超过10%~15%,则提示存在时间和温度依赖性抑制物[19]。如需明确是否有FⅧ抑制物,应结合凝血因子活性和凝血因子抑制物检测结果综合分析。建议5应建立本地实验室的临界值并定期验证。(三)APTT纠正试验结果分析1.APTT纠正试验结果分析与意义:通过以上方法进行APTT纠正试验结果判定后,可在检验报告单中做相应的解释。根据CLSI‑H47A2[24],在常用的APTT纠正试验方法中,任一解释为“纠正”的结果均可以算作“纠正”。APTT纠正试验结果分析与意义见图2。2.临床上导致APTT延长的原因:主要见于凝血因子缺乏、凝血因子抑制物、LA以及某些抗凝药物的干扰等,可以联合PT、TT试验和确认试验明确诊断,详见表1。五、APTT纠正试验操作注意事项与局限性1.检验前影响因素:在做APTT纠正试验之前,应排除检验前因素对检验结果的影响,如肝素污染、抗维生素K治疗、凝血酶抑制剂或溶栓剂的存在等[1,24]。由于不同APTT试剂对凝血因子缺乏、LA和其他抑制物的敏感性不同,所以了解本地实验室试剂性能有助于结果解释。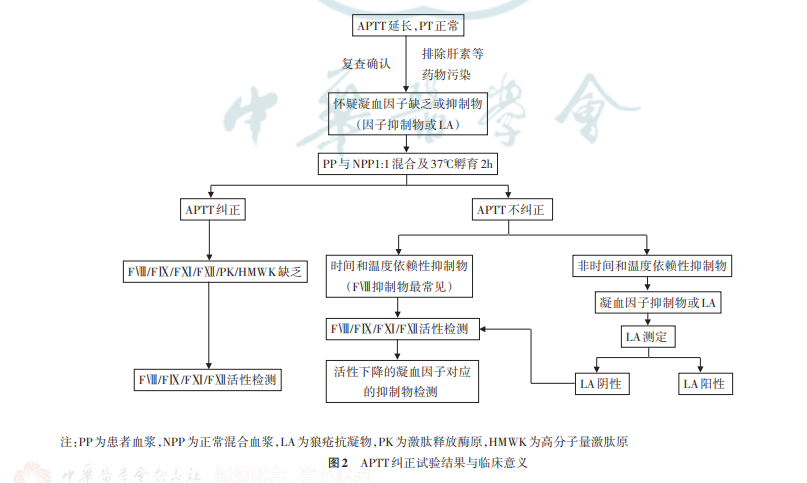

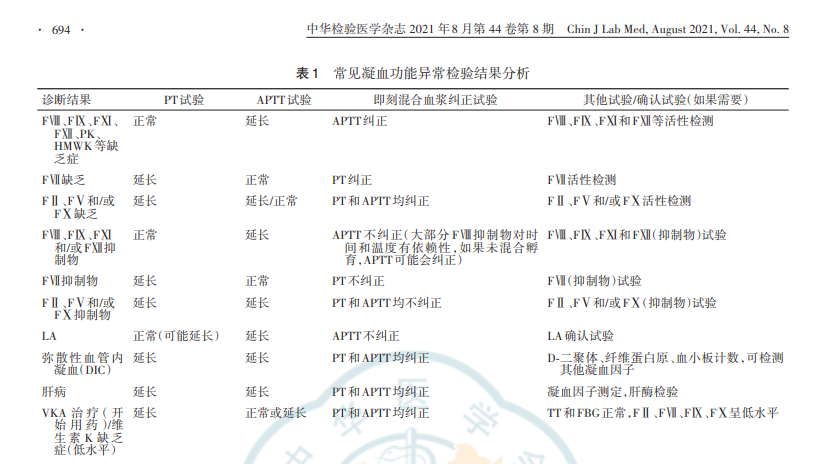
2.关于混合比例:APTT纠正试验待测血浆和NPP的混合比例最典型的是1︰1,可以使用不同的方法来识别纠正与否,为绝大多数临床病例提供有效的鉴别,并可以作为LA诊断策略的一部分[15,25‑28],但没有一种方法能够完全正确地将凝血因子缺乏与抑制物进行鉴别[8]。在实际检验过程中可选择其他比例进行混合,如4︰1及1︰4的混合比例,在某些病例中,4︰1比1︰1混合对于抑制物具有更高的敏感性和特异性,会使结果更清晰。使用4∶1混合标本的百分比纠正法公式[17,29],可有效地鉴别LA和凝血因子缺乏的标本[8]。3.选择Rosner指数判断是否纠正的优点:目前RI方法和百分比纠正法是研究得最好、应用最广泛的方法。选择RI判断是否纠正反映患者、对照及混合APTT的相对关系更为合理,当正常混合血浆制备不当(对照APTT偏高或偏低)或多重凝血因子缺乏(患者APTT过高)时,固定阈值(如NRR/NRI等方法)的判断准确度均不及RI。APTT试剂更换品牌或批号时,固定阈值可能需要重新验证或确定。RI方法和百分比纠正法具有互补性,有助于减少LA假阳性或假阴性的发生[30]。研究[14]表明,确定抑制物(通常是LA)存在的RI临界值为11%或15%。Kershaw和Orellana建议[20,31],临界值11%更适合于当前APTT试剂以及全自动分析仪。APTT延长,PT正常怀疑凝血因子缺乏或抑制物(因子抑制物或LA)APTT纠正APTT不纠正FⅧ/FⅨ/FⅪ/FⅫ/PK/HMWK缺乏FⅧ/FⅨ/FⅪ/FⅫ活性检测时间和温度依赖性抑制物(FⅧ抑制物最常见)非时间和温度依赖性抑制物FⅧ/FⅨ/FⅪ/FⅫ活性检测活性下降的凝血因子对应的抑制物检测凝血因子抑制物或LALA测定LA阴性LA阳性排除肝素等药物污染复查确认PP与NPP1:1混合及37℃孵育2h注:PP为患者血浆,NPP为正常混合血浆,LA为狼疮抗凝物,PK为激肽释放酶原,HMWK为高分子量激肽原图2APTT纠正试验结果与临床意义·693·fmx_T3RoZXJNaXJyb3Jz中华检验医学杂志2021年8月第44卷第8期ChinJLabMed,August2021,Vol.44,No.84.关于LA:如果LA滴度较弱,APTT纠正试验稀释了LA的滴度,则很难区别低滴度的LA标本与LA阴性标本,特别是使用低LA敏感性的试剂[11],可能导致假阴性结果[11,32‑34]。此外,一些LA阳性的患者进行抗凝治疗也很难鉴别出来[11,28,33]。APTT纠正试验对于高滴度LA标本的检测可能至关重要,应该在稀释蝰蛇毒凝血时间试验筛选试验时间延长且LA比率“正常”的情况下应用[28,35]。研究[36]发现APTT纠正试验中混合血浆的APTT较患者APTT延长而不是缩短,将PP与NPP1∶1混合后,稀释蝰蛇毒凝血时间试验和硅凝固时间的比率均显著增加,这种通过正常血浆成分增加抑制物活性的现象称为“狼疮辅助因子”现象。该现象可能是凝血酶原导致的,也有学者认为是由β2‑糖蛋白1(β2‑GP1)所驱动[36‑37]。所以,解释纠正试验的结果较为复杂,有时需要出凝血专家提供咨询以解决疑难的临床情况[38]。5.关于孵育试验:如果APTT纠正试验明确仅用于LA的筛查,患者无出血表现,则无需做孵育试验。尽管FⅧ抑制物是时间和温度依赖性的,但有研究发现抑制物滴度足够高,可即刻完全中和混合血浆中的FⅧ活性[39],而一些弱的FⅧ抑制物可能在即刻混合后纠正。不同文献推荐的时间和温度依赖性抑制物的临界值差异较大,在3~10s之间[3,20,23],应根据经验建立本实验室的临界值并定期验证。表1常见凝血功能异常检验结果分析诊断结果FⅧ、FⅨ、FⅪ、FⅫ、PK、HMWK等缺乏症FⅦ缺乏FⅡ、FⅤ和/或FⅩ缺乏FⅧ、FⅨ、FⅪ和/或FⅫ抑制物FⅦ抑制物FⅡ、FⅤ和/或FⅩ抑制物LA弥散性血管内凝血(DIC)肝病VKA治疗(开始用药)/维生素K缺乏症(低水平)VKA疗法(用药患者稳定)/维生素K缺乏(高水平)达比加群利伐沙班阿哌沙班普通肝素(治疗水平)普通肝素(高于治疗水平)PT试验正常延长延长正常延长延长正常(可能延长)延长延长延长延长正常/延长延长正常/可能延长正常(除非试剂不含肝素中和剂,或肝素含量超过肝素中和剂)延长APTT试验延长正常延长/正常延长正常延长延长延长延长正常或延长延长延长正常或延长正常/可能延长延长延长即刻混合血浆纠正试验APTT纠正PT纠正PT和APTT均纠正APTT不纠正(大部分FⅧ抑制物对时间和温度有依赖性,如果未混合孵育,APTT可能会纠正)PT不纠正PT和APTT均不纠正APTT不纠正PT和APTT均纠正PT和APTT均纠正PT和APTT均纠正PT和APTT均纠正APTT不纠正PT不纠正如果延长,PT/APTT不纠正,但应取决于判定纠正的方法(可纠正为NRI)APTT不纠正APTT不纠正,PT纠正/不纠正(如果将肝素稀释到肝素中和剂范围内可能会纠正,与患者肝素用量、试剂成分及含量相关)其他试验/确认试验(如果需要)FⅧ、FⅨ、FⅪ和FⅫ等活性检测FⅦ活性检测FⅡ、FⅤ和/或FⅩ活性检测FⅧ、FⅨ、FⅪ和FⅫ(抑制物)试验FⅦ(抑制物)试验FⅡ、FⅤ和/或FⅩ(抑制物)试验LA确认试验D‑二聚体、纤维蛋白原、血小板计数,可检测其他凝血因子凝血因子测定,肝酶检验TT和FBG正常,FⅡ、FⅦ、FⅨ、FⅩ呈低水平TT正常,FⅡ、FⅦ、FⅨ、FⅩ呈低水平稀释凝血酶时间(dTT)或质谱法用于确认,TT延长利伐沙班(抗‑Ⅹa)检测或质谱法可用于确认,TT正常阿哌沙班(抗‑Ⅹa)测定法或质谱法可用于确认,TT正常肝素(抗‑Ⅹa)试验,TT延长常并TT混合血浆纠正试验为“不纠正”,鱼精蛋白、甲苯胺蓝纠正试验能纠正可提示,蕲蛇酶或爬虫酶时间正常。但可能有与其他药物如达比加群一起使用的情况肝素(抗‑Ⅹa)试验,TT延长常并TT混合血浆纠正试验为“不纠正”,鱼精蛋白、甲苯胺蓝纠正试验能纠正可提示,蕲蛇酶或爬虫酶时间正常。但可能有与其他药物如达比加群一起使用的情况注:PK为激肽释放酶原,HMWK为高分子量激肽原,VKA为维生素K拮抗剂,NRI为正常参考区间·694·fmx_T3RoZXJNaXJyb3Jz中华检验医学杂志2021年8月第44卷第8期ChinJLabMed,August2021,Vol.44,No.86.纠正试验的自动化:传统APTT纠正试验是手工进行的,影响因素很多,实验室检验人员的技能是关键因素。目前有出凝血分析仪可自动化进行即刻APTT纠正试验和孵育试验。与手工操作相比,自动化APTT纠正试验的优势在于可以减少由手工操作引起的技术差异,同时所需的血浆体积更小,并能够缩短TAT,保证分析结果的可靠性[40]。7.复杂情况的结果分析:当同时存在多种抑制物或抑制物与凝血因子缺乏同时存在时,结果解释将变得复杂,需结合患者病史、临床表现和其他凝血检查进行综合分析。血栓与止血涵盖医疗各专业领域,必要的备注说明和相关建议更能体现检验结果价值的增值,从而更好服务医患。总之,APTT纠正试验应在有出凝血专业知识的专家指导下和特定的临床场景中进行操作,标准化的APTT纠正试验结果对异常APTT的原因提供初始的评价,有助于指导进一步凝血因子或抑制物检测试验的选择,从而节约成本和时间,使诊断效率最大化,最终保障检测质量和患者安全[12]。执笔人:周洲(北京阜外医院检验科),宋鉴清(中国医科大学附属第一医院检验科)专家组成员(以姓氏笔画为序):马汝飞(河南省人民医院检验科),王贤(南京鼓楼医院检验科),伍柏青(江西省人民医院检验科),刘超男(四川大学华西医院检验科),安倍莹(吉林大学第一医院检验科),许宏敏(天津市第三中心医院检验科),孙海燕(上海交通大学医学院附属新华医院检验科),寿玮龄(中国医学科学院北京协和医院检验科),杜佳(武汉亚洲心脏病医院检验科),李传保(北京医院检验科),李强(南方医科大学南方医院检验科),吴映娥(汕头大学医学院第一附属医院检验科),宋鉴清(中国医科大学附属第一医院检验科),张文静(北京大学第三医院检验科),张洋(中国医学科学院阜外医院检验科),张福勇(广西医科大学第一附属医院检验科),张磊(西安交通大学第二附属医院检验科),陈要朋(解放军联勤保障部队第九二三医院检验科),陈振萍(首都医科大学附属北京儿童医院检验科),周旭红(广州医科大学附属第二医院检验科),周洲(中国医学科学院阜外医院检验科),周静(四川大学华西医院检验科),房云海(山东省血液中心山东省血友病诊疗中心检验科),赵学峰(南方医科大学附属南海医院检验科),袁莉(西安交通大学第一附属医院检验科),唐宁(华中科技大学同济医学院附属同济医院检验科),黄丽(南宁市第二人民医院检验科),楼金吐(浙江大学医学院附属儿童医院检验科),樊彩兰(山西医科大学第一医院检验科),戴菁(上海交通大学医学院附属瑞金医院检验科)利益冲突所有作者均声明不存在利益冲突参考文献[1]FavaloroE.Mixingstudiesforlupusanticoagulant:mostlyyes,sometimesno[J].ClinChemLabMed,2020,58(4):487‐491.DOI:10.1515/cclm‐2019‐1240.[2]BlennerhassettR,FavaloroE,PasalicL.Coagulationstudies:achievingtherightmixinalargelaboratorynetwork[J].Pathology,2019,51(7):718‐722.DOI:10.1016/j.pathol.2019.07.006.[3]ChenJ,PhillipsB,ChandlerWL.Evaluationofprothrombintimeandactivatedpartialthromboplastintimemixingstudiesusinganestimatedfactorcorrectionmethod[J].BloodCoagulFibrinolysis,2016,27(1):90‐96.DOI:10.1097/MBC.0000000000000375.[4]WinterWE,FlaxSD,HarrisNS.CoagulationTestingintheCoreLaboratory[J].LabMed,2017,48(4):295‐313.DOI:10.1093/labmed/lmx050.[5]MohammadE,ThachilJ.Mixingstudiesforabnormalcoagulationscreen‐thecurrenttrend[J].ClinChemLabMed,2017,55(3):e54‐e55.DOI:10.1515/cclm‐2016‐0595.[6]ChoiSH,RamballyS,ShenYM.MixingStudyforEvaluationofAbnormalCoagulationTesting[J].JAMA,2016,316(20):2146‐2147.DOI:10.1001/jama.2016.15749.[7]尚红,王毓三,申子瑜.全国临床检验操作规程(第4版)[M].人民卫生出版社,2015.[8]FavaloroEJ.Coagulationmixingstudies:Utility,algorithmicstrategiesandlimitationsforlupusanticoagulanttestingorfollowupofabnormalcoagulationtests[J].AmJHematol,2020,95(1):117‐128.DOI:10.1002/ajh.25669.[9]BakerP,PlattonS,GibsonC,etal.Guidelinesonthelaboratoryaspectsofassaysusedinhaemostasisandthrombosis[J].BrJHaematol,2020,191(3):347‐362.DOI:10.1111/bjh.16776.[10]龚娅,何宗忠,王晓冬,等.自制混合血浆在血浆纠正试验中的临床应用初探[J].检验医学与临床,2015,12(16):2357‐2358,2361.DOI:10.3969/j.issn.1672‐9455.2015.16.023.[11]TripodiA.Tomixornottomixinlupusanticoagulanttesting?Thatisthequestion[J].SeminThrombHemost,2012,38(4):385‐389.DOI:10.1055/s‐0032‐1304717.[12]中华人民共和国国家卫生和计划生育委员会.WS/T359‐2011血浆凝固实验血液标本的采集及处理指南.http://www.nhc.gov.cn/cms‐search/xxgk/getManuscriptXxgk.htm?id=53787.[13]YatesSG,FittsE,DeSimoneN,etal.Prolongedpartialthromboplastintime:Tomixornottomix‐isthatthequestion?[J].TransfusApherSci,2019,58(1):39‐42.DOI:10.1016/j.transci.2018.11.004.[14]BenzonHT,ParkM,McCarthyRJ,etal.Mixingstudiesinpatientswithprolongedactivatedpartialthromboplastintimeorprothrombintime[J].AnesthAnalg,2019,128(6):1089‐1096.DOI:10.1213/ANE.0000000000003457.[15]ClinicalandLaboratoryStandardsInstitute.H60‐ALaboratoryTestingfortheLupusAnticoagulant;ApprovedGuideline[S].Wayne,PA:CLSI,2014.[16]MooreGW.Mixingstudiesforlupusanticoagulant:mostlyno,sometimesyes[J].ClinChemLabMed,2020,58(4):492‐495.DOI:10.1515/cclm‐2019‐1248.·695·fmx_T3RoZXJNaXJyb3Jz中华检验医学杂志2021年8月第44卷第8期ChinJLabMed,August2021,Vol.44,No.8[17]ChangSH,TillemaV,ScherrD.A"percentcorrection"formulaforevaluationofmixingstudies[J].AmJClinPathol,2002,117(1):62‐73.DOI:10.1309/RREK‐8L6M‐D2KC‐HWLH.[18]HongSK,HwangSM,KimJE,etal.Clinicalsignificanceofthemixingtestinlaboratorydiagnosesoflupusanticoagulant:thefateofthemixingtestinintegratedlupusanticoagulanttestsystems[J].BloodCoagulFibrinolysis,2012,23(8):739‐744.DOI:10.1097/MBC.0b013e328358e899.[19]中华医学会血液学分会血栓与止血学组,中国血友病协作组.凝血因子Ⅷ/Ⅸ抑制物诊断与治疗中国指南(2018年版)[J].中华血液学杂志,2018,39(10):793‐799.DOI:10.3760/cma.j.issn.0253‐2727.2018.10.001.[20]KershawG,OrellanaD.Mixingtests:diagnosticaidesintheinvestigationofprolongedprothrombintimesandactivatedpartialthromboplastintimes[J].SeminThrombHemost,2013,39(3):283‐290.DOI:10.1055/s‐0033‐1336832.[21]DepreterB,DevreeseKM.DifferencesinlupusanticoagulantfinalconclusionthroughclottingtimeorRosnerindexformixingtestinterpretation[J].ClinChemLabMed,2016,54(9):1511‐1516.DOI:10.1515/cclm‐2015‐0978.[22]李刚,陈振萍,唐凌,等.血浆纠正试验差值在血友病A患儿抑制物中的诊断价值[J].检验医学与临床,2015(23):3451‐3452,3455.DOI:10.3969/j.issn.1672‐9455.2015.23.001.[23]TangN,ChenY,LiD,etal.DeterminingthecutoffvalueoftheAPTTmixingtestforfactorⅧinhibitor[J].ClinChemLabMed,2019,57(5):e88‐e90.DOI:10.1515/cclm‐2018‐0794.[24]ClinicalandLaboratoryStandardsInstitute.H47‐A2One‐StageProthrombinTime(PT)TestandActivatedPartialThromboplastinTime(APTT)Test;ApprovedGuideline‐SecondEdition[S].Wayne,PA:CLSI,2008.[25]KeelingD,MackieI,MooreGW,etal.Guidelinesontheinvestigationandmanagementofantiphospholipidsyndrome[J].BrJHaematol,2012,157(1):47‐58.DOI:10.1111/j.1365‐2141.2012.09037.x.[26]MooreGW.Commonalitiesandcontrastsinrecentguidelinesforlupusanticoagulantdetection[J].IntJLabHematol,2014,36(3):364‐373.DOI:10.1111/ijlh.12227.[27]PengoV,TripodiA,ReberG,etal.Updateoftheguidelinesforlupusanticoagulantdetection.SubcommitteeonLupusAnticoagulant/AntiphospholipidAntibodyoftheScientificandStandardisationCommitteeoftheInternationalSocietyonThrombosisandHaemostasis[J].JThrombHaemost,2009,7(10):1737‐1740.DOI:10.1111/j.1538‐7836.2009.03555.x.[28]DevreeseKM,deLaatB.Mixingstudiesinlupusanticoagulanttestingarerequiredatleastinsometypeofsamples[J].JThrombHaemost,2015,13(8):1475‐1478.DOI:10.1111/jth.13020.[29]ChangS.Moreon:normalplasmamixingstudiesinthelaboratorydiagnosisoflupusanticoagulant[J].JThrombHaemost,2004,2(8):1480‐1481.DOI:10.1111/j.1538‐7836.2004.00847.x.[30]DevreeseKM.Interpretationofnormalplasmamixingstudiesinthelaboratorydiagnosisoflupusanticoagulants[J].ThrombRes,2007,119(3):369‐376.DOI:10.1016/j.thromres.2006.03.012.[31]KershawG.PerformanceandInterpretationofMixingTestsinCoagulation[J].MethodsMolBiol,2017,1646:85‐90.DOI:10.1007/978‐1‐4939‐7196‐1_6.[32]KumanoO,IekoM,NaitoS,etal.Verificationoftheguidelinesforlupusanticoagulantdetection:usefulnessofindexforcirculatinganticoagulantinAPTTmixingtest[J].ThrombRes,2014,134(2):503‐509.DOI:10.1016/j.thromres.2014.05.030.[33]ThomJ,IveyL,EikelboomJ.Normalplasmamixingstudiesinthelaboratorydiagnosisoflupusanticoagulant[J].JThrombHaemost,2003,1(12):2689‐2691.DOI:10.1111/j.1538‐7836.2003.0543h.x.[34]MooreGW,SavidgeGF.TheDilutionEffectofEqualVolumeMixingStudiesCompromisesConfirmationofInhibitionbyLupusAnticoagulantsEvenWhenMixtureSpecificReferenceRangesAreApplied[J].ThrombRes,2006,118(4):523‐528.DOI:doi.org/10.1016/j.thromres.2005.09.010.[35]FavaloroEJ,BonarR,ZebeljanD,etal.Laboratoryinvestigationoflupusanticoagulants:mixingstudiesaresometimesrequired[J].JThrombHaemost,2010,8(12):2828‐2831.DOI:10.1111/j.1538‐7836.2010.04090.x.[36]MagrathM.Lupuscofactorphenomenon[J].JClinPathol,1990,43(3):264.DOI:10.1136/jcp.43.3.264.[37]PengoV,ZardoL,CattiniMG,etal.Prothrombinisresponsibleforthelupuscofactorphenomenoninapatientwithlupusanticoagulant/hypoprothrombinemiasyndrome[J].THOpen,2020,4(1):e40‐e44.DOI:10.1055/s‐0040‐1705091.[38]GreenD.Interpretingcoagulationassays[J].BloodCoagulFibrinolysis,2010,21Suppl1:S3‐6.DOI:10.1097/01.mbc.0000388935.77612.d0.[39]KumanoO,MooreGW.Rulingoutlupusanticoagulantswithmixingtest‐specificcutoffassessmentandtheindexofcirculatinganticoagulant[J].ResPractThrombHaemost,2019,3(4):695‐703.DOI:10.1002/rth2.12245.[40]OhsakaA,IshiiK,YamamotoT,etal.Automatedmixingstudiesandpatternrecognitionforthelaboratorydiagnosisofaprolongedactivatedpartialthromboplastintimeusinganautomatedcoagulationanalyzer[J].ThrombRes,2011,128(1):86‐91.DOI:10.1016/j.thromres.2011.02.003.·696·fmx
附件:APTT混合血浆纠正试验检验报告单(模板)检验项目APTT1(患者)APTT2(正常混合血浆)APTT3(1︰1混合血浆即刻检测)APTT4(患者孵育2h)APTT5(正常混合血浆孵育2h)APTT6(1∶1混合血浆孵育2h)APTT7(分别孵育2h后1︰1混合血浆)RosnerIndex(RI)孵育后延长时间(APTT6‑APTT7)检测结果参考范围参考范围参考范围-----<10%:凝血因子缺乏(纠正)>15%:抑制物(不纠正)10%~15%:灰区≤3s,非时间和温度依赖性抑制物>3s,时间和温度依赖性抑制物结果判断临床诊断凝血因子缺乏时间和温度依赖性抑制物非时间和温度依赖性抑制物即刻试验APTT3纠正APTT3纠正APTT3不纠正APTT3不纠正37℃孵育2h后试验APTT6纠正APTT6不纠正APTT6不纠正,APTT6‑APTT7>3s或APTT6‑APTT3>临界值APTT6不纠正,APTT6‑APTT7≤3s或APTT6‑APTT3≤临界值
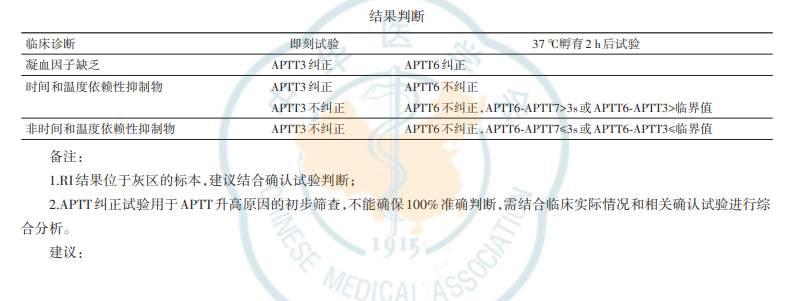
备注:1.RI结果位于灰区的标本,建议结合确认试验判断;2.APTT纠正试验用于APTT升高原因的初步筛查,不能确保100%准确判断,需结合临床实际情况和相关确认试验进行综合分析
本文源自中华检验医学杂志2021年8月第44卷第8期